Ein zweites Leben für CO2
- TU News

Es ist schon fast zu spät: Um das Klimaziel einzuhalten, die globale Erwärmung auf 1,5 °C im Vergleich zum vorindustriellen Zeitraum zu begrenzen, haben wir schon jetzt zu viel Kohlendioxid in die Atmosphäre freigesetzt. Es genügt also nicht mehr, ab sofort die CO2-Emissionen massiv zu senken oder auf Null zu reduzieren: Wir müssen CO2 wieder aus der Atmosphäre entfernen. Zu diesem Schluss kommt der Weltklimarat in einem 2019 veröffentlichten Sonderbericht.
Doch wie lässt sich das CO2 aus der Luft binden? Und wie verhindert man, dass es nach gewisser Zeit erneut in die Atmosphäre gelangt? Daran forscht Professor David Agar von der Fakultät Bio- und Chemieingenieurwesen an der TU Dortmund. „In der Natur binden Pflanzen CO2 in Biomasse“, erklärt er. „Doch das ist nur eine vorübergehende Lösung: Wenn die Pflanzen verrotten, wird das CO2 wieder freigesetzt.“
Verfahren clever kombiniert
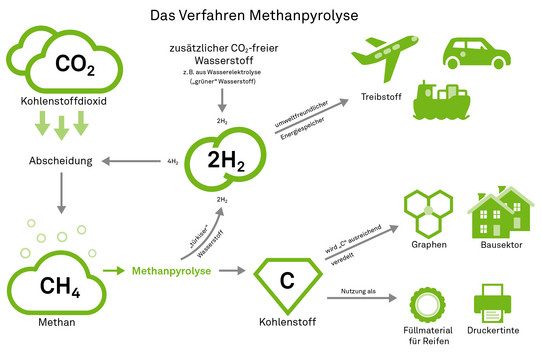
Agar setzt daher auf einen chemischen Ansatz. Dazu nutzt er zunächst feste Adsorptionsmittel, sogenannte Amine, die mit dem CO2 aus der Luft reagieren und es an sich binden. Um das Material erneut verwenden zu können, muss das gebundene Kohlendioxid wieder entfernt werden. „Dieser Prozess erfordert hohe Temperaturen, also viel Energie“, sagt Agar. „Um das Klima nicht zu belasten, kommen dafür nur erneuerbare Energien in Frage.“ Sein Team nutzt eine clevere Kombination, um die benötigte Wärme selbst zu erzeugen und zugleich das aus der Luft gefilterte CO2 weiterzuverarbeiten. „Wir lassen das CO2 mit Wasserstoff zu Methan, also CH4, reagieren. Das ist synthetisches Erdgas“, erklärt er. „Diese Reaktion setzt viel Wärme frei, die wir für die Regeneration der Amine nutzen können. Thermodynamisch ist es also sinnvoll, die Prozesse zu koppeln.“ Aktuell arbeitet sein Team daran, dieses Verfahren effizienter zu gestalten.
Die nächste Frage im Forschungsprozess ist: Was wird aus dem erzeugten Methan? „Man könnte es einfach als Erdgas verbrennen“, erläutert Agar. „Das wäre immerhin CO2-neutral, denn das CO2, das bei der Verbrennung anfällt, haben wir ja vorher aus der Luft gefiltert. Aber letztlich wollen wir ja eine negative CO2-Bilanz erreichen.“ Eine Möglichkeit wäre, das Methan der chemischen Industrie zur Verfügung zu stellen. Hier dient es als Ausgangsstoff für viele chemische Verbindungen. „Doch auch diese würden – ähnlich wie Biomasse – irgendwann wieder zersetzt, und das CO2 würde erneut freigesetzt“, beschreibt Agar.
Endlagerung oder Weiterverarbeitung?
Für eine langfristige Lösung hält er daher geologische Verfahren. Diese haben das Ziel, CO2 aus der Luft dauerhaft im Boden zu lagern. In diesem Fall müsste es nicht unbedingt zunächst zu Methan weiterverarbeitet werden. Einige Technologien, bei denen CO2 mit hohem Druck in unterirdische Lagerstätten, beispielsweise alte Gasfelder, gepresst wird, bergen Risiken, darunter die Gefahr, dass das CO2 wieder entweicht oder dass durch Druckveränderungen Erdbeben ausgelöst werden. In Deutschland sind solche Verfahren daher nicht mehr im Gespräch. Eine andere Möglichkeit ist, CO2 in poröse Basaltfelsen einzuleiten. Dieses Gestein reagiert mit dem CO2 zu Karbonaten, also Mineralien. Die Reaktion läuft langsam ab, bietet aber eine sichere und dauerhafte Form der Lagerung.
Agar selbst verfolgt aber einen anderen Ansatz. Sein Ideal: Das CO2 soll nicht nur aus der Atmosphäre entfernt und möglichst risikoarm gelagert werden – alle Komponenten sollen sinnvoll genutzt werden. Dazu arbeitet er an einem Verfahren namens Methanpyrolyse: „Wir wollen aus dem Methan, das wir bei der CO2-Abscheidung aus der Luft gewonnen haben, Wasserstoff und elementaren Kohlenstoff machen“, erklärt er. Aus einem Molekül CH4 werden dabei ein C (Kohlenstoff) und zwei H2 (Wasserstoff). Der Wasserstoff kann als umweltfreundlicher Energiespeicher beispielsweise als Treibstoff für Wasserstoffautos, Flugzeuge oder Schiffe genutzt werden. Alternativ – und hier schließt sich der Kreis – lässt er sich im ersten Schritt, der CO2-Abscheidung, erneut dazu nutzen, CO2 zu Methan reagieren zu lassen.
Auch der Kohlenstoff hat potenziell zahlreiche Verwendungsmöglichkeiten, zum Beispiel als Pigment in Druckertinte. „Im Moment nutzt ihn vorwiegend die Reifenindustrie als Füllmaterial“, erzählt Agar. „Aber hier sind die Mengen begrenzt.“ Sollte es gelingen, den Kohlenstoff ausreichend zu veredeln, stünden auch höherwertige Anwendungsbereiche offen. „Interessant wäre es, aus dem gewonnenen Kohlenstoff Graphen herzustellen, das dünnste Material der Welt, das aus einer einzigen Schicht miteinander verknüpfter Kohlenstoffatome besteht“, sagt Agar. Graphen ist 200 Mal stärker als Stahl, flexibel und kann als Leiter für Wärme und Elektrizität eingesetzt werden. „Denkbar wären auch Kohlenstofffasern, die zum Beispiel im Bausektor verwendet werden.“
Wenn Kohlenstoff zum Problem wird
Doch solche Anwendungen liegen weit in der Zukunft. Zunächst gilt es, zahlreiche Hindernisse bei der Methanpyrolyse zu überwinden. Würde man Methan unter normalen Bedingungen verbrennen, würde es mit dem Luftsauerstoff zu Wasser und Kohlendioxid reagieren. Das darf bei der Pyrolyse nicht passieren. „Sobald Sauerstoff im Spiel ist, hat man verloren“, sagt Agar. „Wir versuchen daher, das Methan in Abwesenheit von Sauerstoff zu zersetzen.“ Damit sich das CH4-Molekül in seine Bestandteile Kohlenstoff und Wasserstoff spalten lässt, sind Temperaturen oberhalb von 1.000°C erforderlich.


Ein Problem dabei: Während der entstehende Wasserstoff als Gas aufsteigt, lagert sich der Kohlenstoff ab – und zwar ausgerechnet an der heißesten Stelle, der Wand der Rohre. Die entsprechenden Anlagen sind also bald verstopft und durch den Kohlenstoffbelag an den Wänden verringert sich der mögliche Wärmeeintrag. Agar und sein Team verfolgen verschiedene Lösungsansätze für dieses Problem. In einem vom Bundesministerium für Bildung und Forschung geförderten Projekt gemeinsam mit BASF haben die Forscher*innen einen Reaktor mit einem sogenannten Kohlenstoffwanderbett entwickelt.
Hier rieselt kontinuierlich Kohle im Reaktor herunter, an die sich der neu entstehende Kohlenstoff anlagern kann. „So wird der Kohlenstoff abtransportiert und setzt sich nicht an den Wänden ab“, erläutert Agar.
Ein zweiter Lösungsansatz zielt darauf, die Wände gleich ganz zu vermeiden. Statt die Hitze über die Wände zu vermitteln, erzeugt man einen Lichtbogen, also ein aus elektrischer Energie gespeistes Plasma, in dem die Spaltung des Methans stattfindet. „Dieses Verfahren ist flexibel einsetzbar und lässt sich schnell hoch- und runterfahren“, sagt Agar. Der Nachteil ist allerdings, dass es bisher noch sehr energieaufwendig ist und eine schlechte Effizienz hat.

Aus wissenschaftlichem Interesse widmet sich Agar zusätzlich einem dritten Ansatz: „Wir spülen die Wände unseres Reaktors kontinuierlich mit einem Flüssigkeitsfilm aus flüssigem Metall“, berichtet er. Dadurch fließt der Kohlenstoff mit dem Metall ab, die Wände bleiben frei. „Das funktioniert ähnlich wie beim Kohlenstoffbett, nur mit Flüssigkeit statt mit Feststoff. Das hat zum Beispiel Vorteile für den Wärmehaushalt“, so Agar. „In beiden Fällen ist es gut, dass Kohlenstoff und Wasserstoff in unterschiedliche Richtungen den Reaktor verlassen, sodass es keine Rückreaktionen gibt.“
Was ist möglich, was rentabel?
Wirtschaftlich rentabel ist bislang noch keiner der Ansätze. Im industriellen Maßstab wird Wasserstoff bisher vor allem aus fossilem Erdgas durch Umsetzung mit Wasserdampf gewonnen. Da bei der Erzeugung dieses sogenannten „grauen“ Wasserstoffs CO2 freigesetzt wird, trägt er weiter zur Klimaproblematik bei. Doch die Produktion ist so preiswert, dass sie andere, klimafreundliche Technologien bislang verdrängt. Alternativen wären der sogenannte „blaue“ Wasserstoff, der zwar ebenso erzeugt wird wie „grauer“ Wasserstoff, bei dem aber das entstehende CO2 aufgefangen und gespeichert wird, sodass es nicht in die Atmosphäre gelangt, und der „grüne“ Wasserstoff, der durch die Elektrolyse von Wasser mit erneuerbarem Strom hergestellt wird und CO2-frei ist. „Solange man aber CO2-Ausstoß nicht finanziell bestraft, sind diese Technologien nicht konkurrenzfähig“, sagt Agar.

Den Wasserstoff aus Methanpyrolyse, an dem er forscht, bezeichnet man als „türkisen“ Wasserstoff. „Wie rentabel dieses Verfahren ist, hängt auch davon ab, was man mit dem anfallenden Kohlenstoff macht“, erklärt er. Sollte es tatsächlich gelingen, hochwertige Anwendungsmöglichkeiten zu finden, würde dies die Wirtschaftlichkeit deutlich verbessern. Derzeit ist der Kohlenstoff, der bei der Pyrolyse entsteht, allerdings noch zu uneinheitlich. „Das ist aber eher ein Forschungsgebiet der Werkstofftechnik. Wir liefern nur den Kohlenstoff“, sagt Agar. Den Wasserstoff selbst sieht Agar vor allem als Hilfsmittel auf dem Weg zu einer umweltfreundlicheren Energieversorgung. „Der Wasserstoff ist kein Allheilmittel“, sagt er. „Es ist eine gute Möglichkeit, bei erneuerbaren Energien Nachfrage und Angebot auszugleichen und eine längerfristige Speicherung zu ermöglichen.“
Wasserstoffautos hingegen seien gegenüber Elektroautos zu ineffizient. Anders verhält es sich aus seiner Sicht mit Flugzeugen und Schiffen, die umweltfreundlichen Wasserstoff als Treibstoff nutzen. „Durch die langen zurückzulegenden Strecken sind wir hier auf die chemische Energiespeicherung angewiesen. In diesem Fall könnte Wasserstoff fossile Brennstoffe ersetzen.“
Durch die Kombination von CO2-Abscheidung und Methanpyrolyse ist der von Agar erzeugte Wasserstoff nicht nur CO2-neutral, sondern kann tatsächlich zum Ideal einer negativen CO2-Bilanz beitragen. Agar selbst bezeichnet sein Verfahren als Übergangstechnologie: „Wir hoffen, damit einen Beitrag zum Umstieg auf umweltfreundliche Technologieformen zu leisten.“ Damit sich neue Technologien lohnen, seien aber zusätzlich zu wissenschaftlichen Fortschritten vor allem politische Maßnahmen notwendig. Vor allem der Preis für CO2-Zertifikate sei eine wichtige Stellschraube. „Wir sind schon über den Punkt hinaus, wo wir einfach durch Einschränkungen der Emissionen unsere Klimaziele erreichen. Wir müssen aktiv gegen das CO2 in der Atmosphäre arbeiten“, sagt Agar. „Unsere Technologien können einen Baustein dazu liefern.“
Text: Elena Bernard
Zur Person
Prof. David W. Agar ist Professor für chemische Verfahrenstechnik an der Fakultät Bio- und Chemieingenieurwesen. Er studierte Bioingenieurwesen an der University of Wales und wurde an der University of Houston als Chemieingenieur promoviert. Nach einer insgesamt sechzehnjährigen Industrietätigkeit bei der BASF wurde er 1997 Professor für Technische Chemie an der TU Dortmund.
Seine Forschungsschwerpunkte sind unter anderem multifunktionale Reaktoren, Mikroreaktoren, Prozessintensivierung sowie umwelttechnische Anwendungen der Reaktionstechnik. Gemeinsam mit Kollegen von der Fakultät BCI verfasste er das Lehrbuch „Einführung in die Technische Chemie“, das 2011 den Literaturpreis des Fonds der Chemischen Industrie erhielt.